Công ty cổ phần Công nghệ sinh học dược Nanogen (Nanogen), Khu công nghệ cao TP.HCM mới đây có văn bản kiến nghị Thủ tướng xin cấp phép khẩn cấp cho vaccine COVID-19 Nanocovax. Công ty mong muốn được Thủ tướng ủng hộ để Nano Covax sớm được cấp phép khẩn cấp có điều kiện, tương tự các loại vaccine của Nga, Trung Quốc và Ấn Độ. Tuy nhiên kiến nghị bị Bộ Y tế và các chuyên gia cho là nóng vội, chưa đủ cơ sở khoa học.
Vaccine Nano Covax đang thử nghiệm giai đoạn 3 trên quy mô 13.000 người. 1.000 mũi tiêm đầu tiên vừa được Học viện Quân y cùng Viện Pasteur TP.HCM hoàn thành. Sức khỏe các tình nguyện viên đều ổn định.
Qua hai giai đoạn thử nghiệm trước, vacicne này được Hội đồng đạo đức Bộ Y tế đánh giá tốt. Dựa trên các kết quả thử nghiệm lâm sàng, khả năng sinh miễn dịch của Nano Covax đạt 99,4%. Nếu so sánh với các loại vaccine khác trên thế giới thì vaccine của Việt Nam không hề thua kém và có phần cao hơn. Trong khi giá bán dự kiến đang thấp nhất thế giới, chỉ 120.000 đồng/liều. Dự kiến trong giai đoạn 3, vaccine có thể đạt hiệu quả bảo vệ khoảng 90%, tương đương với các vaccine trên thế giới.
Theo Công ty Nanogen, đến nay công suất sản xuất của nhà máy ước đạt 8-12 triệu liều/tháng. Nanogen đang hoàn thiện, mở rộng hệ thống kho lạnh với sức chứa 10 triệu liều cũng như đội ngũ xe lạnh (2-8°C) vận hành đạt chuẩn quốc tế.
Dựa trên kế hoạch và năng lực hiện tại, công ty dự kiến cung cấp đủ 50 triệu liều đến tháng 12/2021 và 100 triệu liều vào năm 2022. Công ty cũng khẳng định quyết tâm đẩy mạnh nghiên cứu, sản xuất cung cấp đủ vaccine để Việt Nam đạt được miễn dịch cộng đồng vào quý 2/2022.
"Công ty rất tự tin vào sản phẩm của mình”, đại diện Nanogen khẳng định.
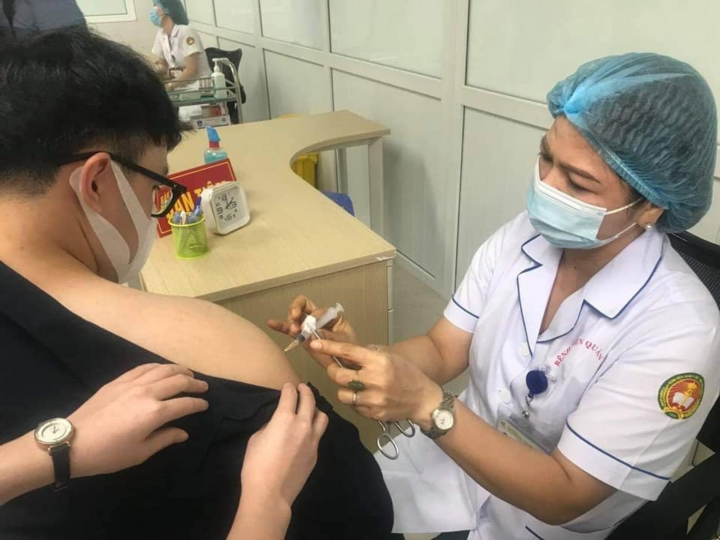
Các tình nguyện viên tham gia thử nghiệm vaccine COVID-19 Nanocovax giai đoạn 3 tại Học viện Quân y. (Ảnh: Thái Bình)
Theo PGS-TS Chử Văn Mến, Giám đốc Trung tâm Thử nghiệm lâm sàng và tương đương sinh học, Học viện Quân y, ở giai đoạn 3, 13.000 tình nguyện viên tiêm 1 mũi duy nhất liều lượng 25 mcg, tại nhiều địa điểm trên cả nước.
Ở miền Bắc, vaccine trên thử nghiệm ở Học viện Quân y và Hưng Yên. Còn phía Nam, Viện Pasteur TP.HCM và Long An tham gia. Các tình nguyện viên tham gia thử nghiệm giai đoạn này chia làm 2 nhóm. Nhóm 1 tiêm liều vaccine Nanocovax 25 mcg và nhóm 2 sẽ tiêm giả dược với thành phần tá dược nhôm.
Trong 1.000 người vừa được tiêm, phía Bắc khoảng 880 người; phía Nam hơn 120 người tại Bến Lức. Những người này được tiêm theo tỷ lệ 6:1, tức 6 người tiêm vaccine, 1 người tiêm giả dược.
Dự kiến ngày 30/7, các tình nguyện viên hoàn thành việc lấy máu xét nghiệm để đánh giá khả năng sinh miễn dịch.
Theo kế hoạch, các mẫu máu được làm xét nghiệm trong vòng 1 tháng. Dự kiến đến giữa tháng 9/2021 sẽ có báo cáo kết quả dữ liệu về an toàn và sinh miễn dịch vào D42 (ngày thứ 42 sau khi tiêm) cho 1.000 tình nguyện viên.
Sau 28 ngày, nhóm này sẽ được tiêm mũi 2. Sau tiêm mũi thứ 2, nhóm nghiên cứu sẽ có dữ liệu để đánh giá về tính an toàn, khả năng sinh miễn dịch và hiệu quả của vaccine trên đối với các biến chủng được phát hiện lần đầu tiên ở Anh, Nam Phi và Ấn Độ.
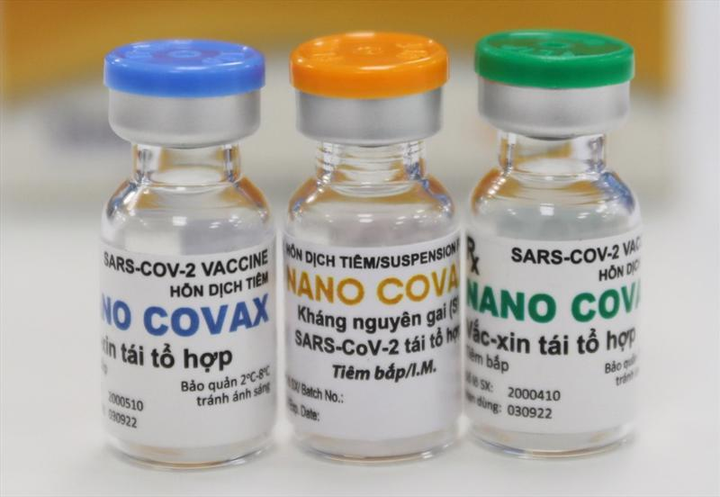
Vaccine COVID-19 "made in Vietnam" Nanocovax.
Tiếp đó, 12.000 tình viện nguyện này ở Hà Nội, Hưng Yên, Long An, Tiền Giang... tiếp tục tham gia thử nghiệm giai đoạn 3B. Họ được tiêm theo tỷ lệ 2:1, tức 2 người tiêm vacicne, 1 người tiêm giả dược.
Ở giai đoạn 3, tác dụng của vaccine với biến thể của SARS-CoV-2 tìm thấy lần đầu tại Ấn Độ cũng sẽ được nghiên cứu, đánh giá. Nếu thuận lợi, đến cuối tháng 9, thử nghiệm giai đoạn 3 sẽ hoàn tất.
Nanocovax là vaccine phòng COVID-19 do Học viện Quân y phối hợp với Công ty Nanogen nghiên cứu phát triển. Đây là vaccine đầu tiên của Việt Nam thử nghiệm lâm sàng trên người dựa trên công nghệ tái tổ hợp protein và là 1 trong 15 vaccine ngừa COVID-19 trên thế giới đang thử nghiệm lâm sàng giai đoạn 3. Đối với biến chủng Delta (ở Ấn Độ), nhóm nghiên cứu cũng đã gửi mẫu huyết thanh để làm xét nghiệm đánh giá khả năng trung hòa virus.
Thử nghiệm lâm sàng giai đoạn 1 diễn ra từ ngày 17/12/2020, đến cuối tháng 4 vừa qua hoàn thành thử nghiệm giai đoạn 2 trên 560 tình nguyện viên, mở rộng đối tượng từ 18 đến trên 60 tuổi, trong đó một số người có bệnh nền như tăng huyết áp, rối loạn mỡ máu, tiểu đường, tim mạch độ 1... không quá nặng.
Bộ Y tế cho biết, theo quy định của Tổ chức Y tế Thế giới (WHO) và các nước như Mỹ, châu Âu, Nhật, Hàn Quốc… một loại vaccine trước khi đưa vào sử dụng khẩn cấp bắt buộc phải thử nghiệm lâm sàng trên người với 3 giai đoạn.
Thử nghiệm lâm sàng giai đoạn 1 và 2 được thực hiện ở quy mô nhỏ trên một số nhóm quần thể để kiểm tra độ an toàn, tính sinh miễn dịch và xác định liều lượng tối ưu. Việc đánh giá tính sinh miễn dịch trong giai đoạn 1 và 2 này không phải là yếu tố quyết định cho việc phê duyệt khẩn cấp. Chỉ có kết quả thử nghiệm lâm sàng giai đoạn 3 mới là yếu tố quyết định để đánh giá vaccine này có hiệu quả bảo vệ hay không, làm giảm nguy cơ mắc COVID-19 hay không hoặc giảm nhẹ tình trạng bệnh hay không.
Giống như thông lệ quốc tế, tất cả vaccine COVID-19 trước khi đưa vào sử dụng khẩn cấp tại Việt Nam đều phải tuân thủ thử nghiệm lâm sàng qua 3 giai đoạn, trên nguyên tắc đảm bảo 3 yếu tố: An toàn, sinh miễn dịch và quan trọng nhất là hiệu quả bảo vệ.


Bình luận